免疫检查点抑制剂和嵌合抗原受体T细胞免疫疗法等免疫治疗在肿瘤领域的应用取得了显著的疗效,但同时也伴随着免疫相关不良反应(irAEs)的风险。其中重度irAEs可能会危及患者的生命,因此对其预防和治疗显得尤为重要。本文主要探讨了重度irAEs的治疗和预防,为更好地管理重度irAEs相关不良事件提供参考依据。
免疫治疗及不良反应
免疫抗肿瘤药物利用人体天然的抗肿瘤免疫反应去攻击和杀死肿瘤,免疫检查点的作用是关闭免疫反应以防止自身免疫反应和损伤健康细胞,但肿瘤可通过“失活”辨别出肿瘤的T细胞而劫持这个机制,从而防止对肿瘤细胞的攻击和破坏[1]。免疫检查点抑制剂比如PD-1/PD-L1抑制剂和CTLA-4抑制剂可阻止这种失活并增加人体的抗肿瘤免疫反应。
由于阻断了防止免疫过度活化的人体天然防卫系统,免疫抑制剂起作用时,既增强了免疫系统对肿瘤细胞的杀伤作用。同时也会攻击健康组织,导致自体免疫相关的副作用,免疫检查点抑制剂相关不良反应和化疗及靶向治疗引起的不良反应机制不同,不良反应的类型也不同,因此也需要不同的管理策略[2]。
免疫检查点抑制剂相关不良反应有什么特点
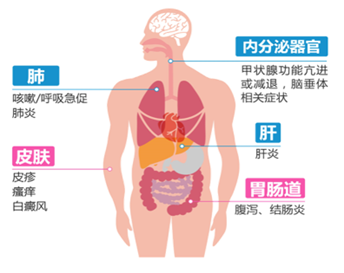
免疫检查点抑制剂相关不良反应可影响所有器官或组织,最常发生的部位为皮肤、结肠、肺、肝脏和内分泌器官(如垂体或甲状腺)(图1)。这些不良反应多数是轻度至中度的,如果及早发现并适当处理,大多数都是可逆的,对于患者所要做的最重要的事情就是:若有任何新症状或症状加重或者任何让你不安的任何症状,请告诉主管医生或相应肿瘤治疗小组人员。
不良反应通常再开始治疗的几周或几个月内出现,但也可以在治疗过程中任何时间发生。可能发生在初次输注药物后几天,也可以发生在治疗结束后一年内。
如何对免疫检查点抑制剂相关不良反应进行管理
根据不良反应的严重程度,可将不良反应分为1-4四个等级(图2),发生1-2级的不良反应时可不停止免疫检查点抑制剂治疗而仅采取对症处理,但若2级别症状持续存在时,则可能需要暂时停止输注免疫检查点抑制剂药物,直至相应症状缓解或消除。发生≥3级不良反应时,通常需要停止输注免疫检查点抑制剂药物,并请相应专科医生会诊或邀请专有免疫不良反应医疗团队管理[3]。不良反应管理最重要、最有效的策略就是早发现和早治疗,因此患者出现新症状或原有症状恶化时,应尽快告知医生。
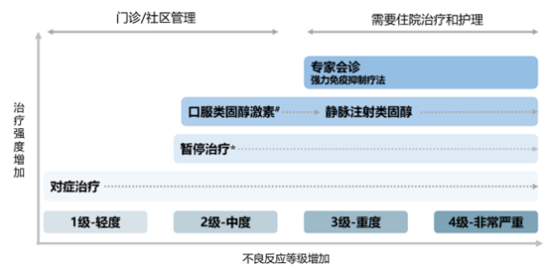
免疫检查点抑制剂相关不良反应的分级
CTCAE(不良事件通用术语标准)是由美国国家癌症研究所癌症治疗评估计划制定的,是对治疗的患者所经历的不良事件进行定义和分解的多学科协同努力的全球标准,CTCAE分级的依据是不良事件对临床管理、日常生活活动、药物剂量调整或停药的潜在影响。免疫检查点抑制剂相关不良反应的分级也采用CTCAE分级标准[4](图3)。

以上只是通用标准,具体到发生的不良反应还需要根据不良反应的分级标准进行分级和治疗。
免疫检查点抑制剂相关不良反应的发生率
不良反应发生的概率和药物有关,也和患者的个体条件有关。以下均为临床研究中的数据,伊匹木单抗单药治疗时任意级别的irAEs(免疫相关不良反应)发生率为60,3级以上irAEs发生率为10-30%,但需要注意的是,伊匹木单抗的不良反应发生率和剂量有关,剂量降低时不良反应发生率会明显降低。但PD-1/L1单抗的不良反应发生率似乎和剂量无关,单药治疗时3级以上irAEs发生率为15~20%,一般认为耐受性较CTLA4抑制剂更好。免疫检查点抑制联合其他药物治疗时或可增强抗肿瘤疗效,但也会增加irAEs的发生[5]。免疫检查点抑制联合化疗时,免疫检查点抑制剂相关不良反应的特征和免疫检查点抑制剂单药治疗时一致。PD-1/L1和CTLA-4,也没有出现新的不良反应,但不良反应的发生率会显著增加。在纳武利尤单抗和伊匹木单抗联合一线治疗非小细胞肺癌的Ⅲ期临床研究中,纳武利尤单抗和伊匹木单抗联合的任意级别和≥3级的TRAE(治疗相关不良反应)发生率分别为77%和33%;纳武利尤单抗联合化疗的任意级别和≥3级的TRAE发生率分别为92%和56%;而纳武利尤单抗单药治疗的任意级别和≥3级的TRAE发生率分别为66%和20%;单纯化疗的任意级别和≥3级的TRAE发生率分别为82%和36%[6]。联合治疗还会改变常见不良反应的发生部位(器官),irAEs的发生风险增加,发生时间更早。
免疫检查点抑制剂不良反应的发生时间
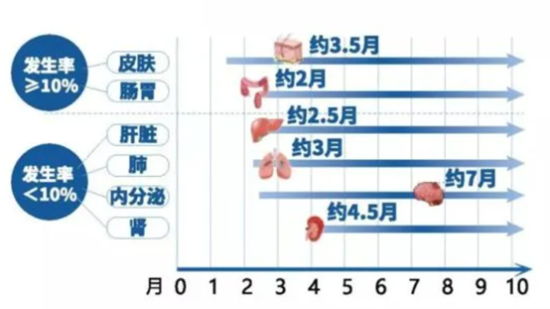
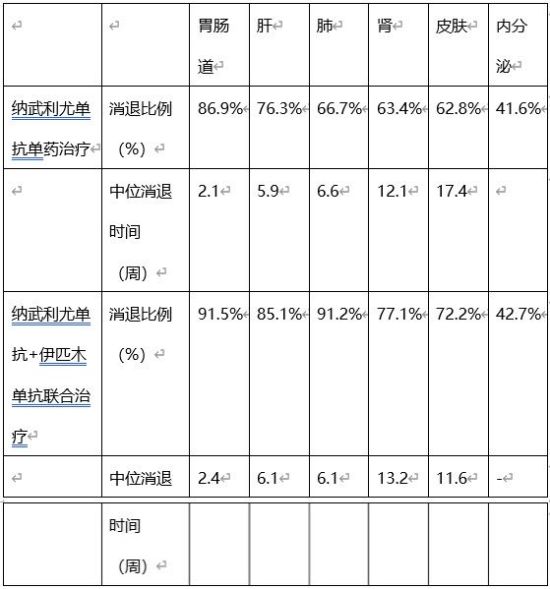
免疫检查点抑制剂不良反应可出现在治疗开始后的任何时间,甚至治疗停止后,但大多数在数周至6个月内发生,如果可早期识别并及时处理,大部分不良反应是轻微且可逆的[7](图4和表1)。
免疫检查点抑制剂相关不良反应的治疗会影响肿瘤治疗的效果吗?
目前缺乏确切的临床证据证实在irAEs发生后使用糖皮质激素等免疫抑制剂会降低免疫检查点抑制剂的疗效,但长期、高剂量的糖皮质激素仍可对治疗有负性影响,而且还需要注意使用糖皮质激素相关的短期和长期不良反应的风险[8]。
免疫检查点抑制剂不良反应和疗效是否有关
与未发生不良反应的患者相比,发生不良反应的患者通常对癌症表现出更好的治疗反应,这表明自身免疫与免疫检查点抑制剂引发的抗肿瘤作用之间存在密切联系,一些研究对不良反应和治疗结果的关系进行了初步的探索。一些研究显示:皮肤不良反应比如皮疹和白癜风,胃肠道不良反应比如腹泻和更好的生存结果相关,风湿性不良反应和神经系统不良反应和更好的抗肿瘤反应相关[9]。而不良反应的哪些特征(受累部位、严重程度、发生时间以及治疗干预)对改善生存起了什么样的作用仍有许多疑问。即便如此,不良反应的发生可能会导致不可逆的器官损害有些甚至是致命的,例如对内分泌系统的损害可能需要长期治疗,3级以上的肺炎可导致不可逆的肺纤维化损害等。
其他不良反应
免疫检查点抑制剂的其他不良反应发生率较低(图5),但以下几种是需要注意的。
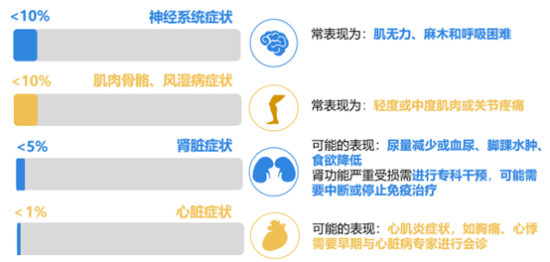
免疫检查点抑制剂相关不良反应的致死率有多少
研究发现免疫检查点抑制剂相关不良反应相关死亡率约0.6%,PD-1抑制剂治疗的患者不良反应相关死亡率约0.36%,PD-L1抑制剂治疗的患者不良反应相关死亡率约0.38%,CTLA-4抑制剂治疗的患者不良反应相关死亡率约1.08%,联合治疗的患者不良反应相关死亡率约1.23%。致死的原因有明显差异,70%的CTLA-4抑制剂相关死亡原因为结肠炎,而PD-1/PD-L1抑制剂相关死亡原因最多见为肺炎(35%),肝炎(22%)和神经系统毒性(15%),PD-1抑制剂/CTLA-4抑制剂联合治疗相关死亡原因最多为结肠炎(37%)和心肌炎(25%)[10]。最后在治疗过程中请您密切留意身体情况,如果健康状况与治疗前相比有变化,无论变化多么细微或看起来没有意义,都可能是irAE的表现,请在发现症状的第一时间向医护人员报告。
及时报告,及时处理,不但有助于改善免疫相关不良症状,也会增加继续接受免疫治疗的可能性,切勿因担心治疗终止而瞒报不良反应。在整个治疗过程中及治疗结束后,都应遵从医嘱、随访监测。(作者,复旦大学附属华东医院胸外科,唐东方,张辉标)
参考文献
1. ESMO (European Society for Medical Oncology, 欧洲肿瘤学会).Immunotherapy-related side effects and their management-An ESMO guide for patients。
2. NCCN. (National Comprehensive Cancer Network, 美国国家综合癌症网络). NCCN Guidelines for Patients®. Immunotherapy Side Effects: Immune Checkpoint Inhibitors. Version 1. 2022.
3. 牛志成,王雷,汪治宇. 免疫检查点抑制剂相关不良反应的管理专家共识[J]. 河北医科大学学报,2021,42(3):249-255. DOI:10.3969/j.issn.1007-3205.2021.03.001.
4. 中国临床肿瘤学会(CSCO)免疫检查点抑制剂相关的毒性管理指南2023. 人民卫生出版社. 北京。
5. Martins F, Sofiya L, Sykiotis GP, Lamine F, Maillard M, Fraga M, Shabafrouz K, Ribi C, Cairoli A, Guex-Crosier Y, Kuntzer T, Michielin O, Peters S, Coukos G, Spertini F, Thompson JA, Obeid M. Adverse effects of immune-checkpoint inhibitors: epidemiology, management and surveillance. Nat Rev Clin Oncol. 2019 Sep;16(9):563-580. doi: 10.1038/s41571-019-0218-0. PMID: 31092901.
6. Sullivan RJ, Weber JS. Immune-related toxicities of checkpoint inhibitors: mechanisms and mitigation strategies. Nat Rev Drug Discov. 2022 Jul;21(7):495-508. doi: 10.1038/s41573-021-00259-5. Epub 2021 Jul 27. PMID: 34316029.
7. Suresh S. Ramalingam, Tudor Eliade Ciuleanu, Adam Pluzanski, et al. Nivolumab + ipilimumab versus platinum-doublet chemotherapy as first-line treatment for advanced non-small cell lung cancer: Three-year update from CheckMate 227 Part 1. Journal of Clinical Oncology 2020 38:15_suppl, 9500.
8. 中国癌症基金会,中华护理学会肿瘤护理专委会. 肿瘤免疫治疗患者教育手册。
26 OPDIVO® (nivolumab) [summary of product characteristics]. Dublin, Ireland: Bristol Myers Squibb。
9. Ramos-Casals M, Brahmer JR, Callahan MK, Flores-Chávez A, Keegan N, Khamashta MA, Lambotte O, Mariette X, Prat A, Suárez-Almazor ME. Immune-related adverse events of checkpoint inhibitors. Nat Rev Dis Primers. 2020 May 7;6(1):38. doi: 10.1038/s41572-020-0160-6. PMID: 32382051; PMCID: PMC9728094.
10. NCCN. (National Comprehensive Cancer Network,美国国家综合癌症网络). NCCN Guidelines®. Management of Immunotherapy-Related Toxicities. Version 1. 2023.
注:请在转载文章内容时务必注明出处!
编辑:许兵






